Изменчивая обёртка
Миелин постоянно образуется и разрушается в человеческом организме. На синтез и распад миелина могут влиять факторы, связанные с особенностями внешней среды. Например, воспитание. С 1965 по 1989 год Румынией руководил Николае Чаушеску. Он установил жесткий контроль над репродуктивным здоровьем и институтом брака в своей стране: усложнил процедуру развода, запретил аборты и ввел ряд стимулов и льгот для женщин, имевших более пяти детей.
Итогом этих мер стало ожидаемое повышение рождаемости. Вместе с рождаемостью увеличилось количество криминальных абортов, не добавивших здоровья румынкам, и возросло количество детей-отказников. Последние воспитывались в детских домах, где с ними не очень-то активно общался персонал.
Румынские дети в полной мере ощутили на себе то, что называется социальной депривацией — лишение возможности полноценного общения с другими людьми. Если речь идет о маленьком ребенке, то следствиями социальной депривации станут нарушение формирования эмоциональных привязанностей и расстройство внимания.
Когда режим Чаушеску пал, западным ученым предстояло в полной мере оценить результат социальной политики этого диктатора. Румынских детей, имеющих выраженные проблемы со вниманием и установкой социальных контактов, впоследствии стали называть детьми Чаушеску.
Кроме различий при выполнении нейропсихологических тестов, у детей Чаушеску по сравнению с детьми, не находившимися в таких условиях, отличалось даже строение головного мозга [8]. При оценке состояния белого вещества мозга ученые используют показатель фрактальной анизотропии.
Он позволяет оценить плотность нервных волокон, диаметр аксонов и их миелинизацию. Чем больше фрактальная анизотропия, тем разнообразнее волокна, которые встречаются в этой области мозга. У детей Чаушеску отмечалось снижение фрактальной анизотропии в пучке белого вещества, соединяющего височную и лобную доли в левом полушарии, то есть связи в этом регионе были недостаточно сложными и разнообразными, с нарушениями миелинизации.
Такое состояние связей мешает нормальному проведению сигналов между височной и лобной долями. В височной доле находятся центры эмоционального реагирования (миндалина, гиппокамп), а орбитофронтальная кора лобной доли также связана с эмоциями и принятием решений.
На миелинизацию также может влиять и состав еды, которую дают ребенку. При белково-энергетической недостаточности питания отмечается снижение образования миелина. Недостаток жирных кислот тоже отрицательно сказывается на синтезе этого ценного вещества, так как оно больше чем на 2/3 состоит из липидов.
Дефицит железа, йода и витаминов группы В приводит к снижению образования миелина [9]. В основном эти данные были получены при изучении лабораторных животных, но история, к сожалению, дала людям возможность оценить влияние недостатка еды и на формирующийся мозг ребенка [10].
Голодная зима (голл. hongerwinter) 1944–1945 гг. в Нидерландах привела к тому, что родилось множество детей, чьи матери плохо питались. Оказалось, что в условиях голодания мозг этих детей формировался с нарушениями. В частности, наблюдалось большое количество нарушений именно в белом веществе, то есть возникали проблемы с формированием миелина. В итоге это приводило к разнообразным психическим расстройствам.
Лейкоэнцефалопатия с «исчезающим белым веществом»
ЛЕЙКОЭНЦЕФАЛОПАТИЯ С «ИСЧЕЗАЮЩИМ БЕЛЫМ ВЕЩЕСТВОМ»
(АТАКСИЯ С ГИПОМИЕЛИНИЗАЦИЕЙ ГОЛОВНОГО МОЗГА, ДИФФУЗНАЯ ПЕРИАКСИАЛЬНАЯ МИЕЛИНОПТИЯ, КРИ ЛЕЙКОЭНЦЕФАЛОПАТИЯ, ЛЕЙКОДИСТРОФИЯ, СОЧЕТАЮЩАЯСЯ С ПОРАЖЕНИЕМ ЯИЧНИКОВ «OVARIOLEUKODYSTROPHY»)
LEUKOENCEPHALOPATHY WITH VANISHING WHITE MATTER; VWM; CHILDHOOD ATAXIA WITH CENTRAL NERVOUS SYSTEM HYPOMYELINIZATION; CACH; VANISHING WHITE MATTER LEUKODYSTROPHY; CREE LEUKOENCEPHALOPATHY; CLE VANISHING WHITE MATTER LEUKODYSTROPHY WITH OVARIAN FAILURE, INCLUDED; OVARIOLEUKODYSTROPHY, INCLUDED
MIM#603896
Генетика: : Генетически гетерогенное заболевание, обусловленное мутациями в генах, кодирующих субъединицы фактора инициации транскрипции eIF2B. eIF2B состоит из 5 субъединиц (eIF2Ba, eIF2Bb, eIF2Bg, eIF2Bd, and eIF2Be), каждая из которых кодируется определенным геном (EIF2B1 картирован на 12q24.3, EIF2B2 картирован на 14q24, EIF2B3 картирован на 1p34.1, EIF2B4 картирован на 2p23.3, и EIF2B5 картирован на 3q27, соответственно).
Тип наследования:аутосомно-рецессивный
Эпидемиология:Точная частота заболевания не известна, вероятно, относится к частым формам лейкоэнцефалопатий у детей и встречается примерно с такой же частотой, как и метахроматическая лейкодистрофия.
Патогенез:Процесс трансляции в клетке один из наиболее важных, сложно регулируемых и требующих больших энергетических затрат. На первой стадии — инициации — рибосома связывается с мРНК и начинает процесс синтеза белка, что контролируется большим числом белковых факторов- эукариотических факторов инициации транскрипции (eIFs). Одним из ключевых факторов является eIF2B, который необходим для присоединения инициирующей метионин тРНК к малой субъединице рибосомы. Все мутации в генах, кодирующих субьединицы фактора eIF2B приводят к снижению его активности и замедлению процесса синтеза белка.
Клинические проявления:в зависимости от возраста дебюта выделяют младенческую, детскую и взрослую формы заболевания. Классический и наиболее часто встречающаяся форма болезни манифестирует в детском возрасте от 2 до 6 лет. Заболевание характеризуется прогрессирующими неврологическими нарушениями, включающими мозжечковую атаксию, спастический тетрапарез, и когнитивные нарушения. Часто встречается атрофия зрительных нервов. У большинства пациентов наблюдаются эпилептические приступы.
При младенческой форме болезни заболевание дебютирует на первом году жизни и быстро прогрессирует. Именно эта форма болезни описывалась как Кри лейкоэнцефалопатия «Cree leukoencephalopathy, манифестирующая в возрасте от 3 до 9 месяцев. Описано несколько случаев с внутриутробной манифестацией болезни — нарушение двигательной активности плода, задержка роста, олигогидроамнион, микроцефалия. У таких пациентов с рождения наблюдались нарушения вскармливания, рвоты, задержка психомоторного развития, повышенная возбудимость, или наоборот апатия, туловищная мышечная гипотония, гипертонус конечностей, судороги, эпизоды апноэ, кома.
Взрослая форма заболевания дебютирует с развития психиатрических нарушений или эпилептических приступов. У некоторых больных в клинической картине доминируют интеллектуальные расстройства, у других — двигательные нарушения. Эпизоды резкого ухудшения, характерные для детской формы, как правило, не встречаются. Заболевание прогрессирует медленно. У женщин довольно часто развивается нарушение функции яичников.
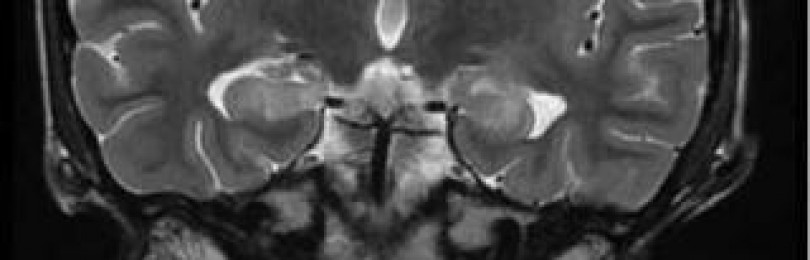
Диагностика:при МРТ головного мозга выявляют поражение белого вещества больших полушарий мозга. На завершающих стадиях заболевания белое вещество практически полностью исчезает и сохраняются только стенки желудочков и кора головного мозга. Для подтверждения диагноза применяют методы ДНК-анализа. Диагностика проводится в лаборатории наследственных болезней обмена веществ МГНЦ РАМН .
Лечение:специфического лечения не разработано. Для профилактики эпизодов декомпенсации пациентам рекомендуют избегать продолжительного воздействия высоких температур (солнечные ванны, посещения бани и сауны), травм головы. При лихорадке необходимо назначение жаропонижающих средств, если необходимо холодовых компрессов.
Прогноз
При ранних формах заболевания прогноз неблагоприятный, быстро развивается тяжелая инвалидизация. При взрослой форме болезнь имеет более доброкачественное, медленное течение.
Магнитно-резонансная томография в диагностике наследственных лейкоэнцефалопатий (обзор литературы)
Первые клинические описания лейкоэнцефалопатий появились в конце XIX — начале XX веков, когда в 1887 г. Губнер, в 1899 и 1910 г. соответственно Пелициус и Мерцбахер, а затем в 1912 г. Шильдер и в 1916 г. Краббе описали ряд заболеваний, сопровождающихся выраженным диффузным поражением белого вещества головного мозга. Вскоре после этого появились предположения о наследственном характере некоторых лейкоэнцефалопатий, основанные на выявлении семейных форм этих заболеваний, однако первые открытия биохимических дефектов, сопровождающих и/или лежащих в их основе, были описаны только спустя 50 лет.
До появления магнитно-резонансной томографии (МРТ) изучение сущности происходящих в ЦНС патологических процессов при лейкоэнцефалопатиях было доступно лишь на основании данных аутопсии. Появление ультразвуковых исследований у новорожденных и рентгеновской компьютерной томографии (КТ) не внесли существенного вклада в изучение этой группы заболеваний, так как оказались при них малоинформативными. Высокопольная МРТ явилась высокочувствительным методом оценки содержания воды в тканях и представляется лучшим современным неинвазивным методом диагностики лейкоэнцефалопатий.
С появлением эры МРТ стало очевидным, что группа наследственных лейкоэнцефалопатий (НЛ) весьма обширна и гетерогенна, и хотя отдельные заболевания из этой группы являются чрезвычайно редкими, группа в целом может соперничать по частоте поражения в популяции с таким заболеванием, например, как рассеянный склероз (РС). Для правильной интерпретации получаемых с помощью МРТ данных чрезвычайно важно знать как специфику МРТ-визуализации, так и морфофункциональные и патогенетические основы нормального строения и функционирования белого вещества ЦНС, а также развития патологических процессов в нем.
Основной морфофункциональной структурой ЦНС является сеть нервных волокон — нейропиль. Нейропиль состоит из кровеносных сосудов, астроцитов, олигодендроцитов, аксонов и их миелиновых оболочек и нейронов. Одним из главных, повреждаемых при НЛ, компонентов нейропиля является миелин, синтезируемый олигодендроцитами.
Миелин — это спиралевидная оболочка аксонов в центральной и периферической нервной системе, имеющая чрезвычайно сложное строение и до конца не известный на сегодняшний день биохимический состав [10]. Миелин преимущественно состоит из липидного бислоя с включением различных белков и гликопротеинов для поддержания стабильности и трансмембранного транспорта. Миелин не является абсолютно стабильным компонентом нейропиля: у новорожденных это самый незрелый компонент вещества мозга, активно формирующийся в течение первых лет жизни и отличающийся по биохимическому составу от зрелого миелина взрослых. У взрослых миелин также является медленно обновляемым компонентом белого вещества, причем установлено, что новообразованный миелин является менее стабильным, чем старый, сформированный в начале жизни. Строение миелина ЦНС и периферической нервной системы (ПНС) имеет некоторые отличия по белковому и гликолипидному составу, что имеет важное значение в избирательности некоторых видов повреждения миелина ЦНС и ПНС [10, 20]. В настоящее время считается, что основная функция миелина — функция электрического изолятора аксонов, обеспечивающая раздельное проведение возбуждения (множественных разнонаправленных, соседствующих электрических сигналов в нейронной сети мозга).
Миелин ЦНС может повреждаться при НЛ первично (при дисмиелинизирующих заболеваниях, вакуолярных миелинопатиях), может иметь место генетически детерминированное нарушение синтеза миелина, либо миелин может повреждаться вслед за другими компонентами нейропиля или сочетанно поражаться вместе с ними. Другие компоненты нейропиля (аксоны, глия, кровеносные сосуды) также могут быть первичными мишенями НЛ, либо повреждаться вторично, вслед за миелином, т.е. повреждающий фактор заболевания может первично воздействовать на один из компонентов нейропиля, вторично приводя к вовлечению других взаимосвязанных компонентов всей системы [2, 8, 20].
Очень важно знание не только строения, но и развития нейропиля. Ключевую роль в развитии мозга после рождения играет процесс миелинизации, начинающийся еще внутриутробно. Этот процесс подробно изучен и продолжает изучаться в настоящее время, в том числе методами современной МР-томографии [7, 20]. Этапы «МРТ-миелинизации» отличаются от миелинизации, изученной иммуногистохимическими методами и методом электронной микроскопии, что связано с большим пространственным разрешением последних и слабой чувствительностью МРТ к постепенно происходящей миелинизации (от внутриутробного периода до третьего года жизни) во временно`м аспекте.
Установлено, что миелинизация нервной системы происходит в закономерной последовательности, которая подчиняется следующим основным правилам: 1) проводящие пути становятся миелинизированными, когда начинают функционировать; 2) процесс миелинизации идет по ходу проведения нервных импульсов; 3) миелинизация начинается в первую очередь в ПНС, а затем происходит в ЦНС; 4) центральные чувствительные отделы ЦНС миелинизируются раньше, чем центральные двигательные пути; 5) миелинизация первичных функциональных зон головного мозга происходит раньше, чем ассоциативных функциональных зон; 6) в общем случае миелинизация идет от каудальных (спинной мозг) к ростральным отделам (диэнцефальные отделы, пре- и постцентральные извилины) и от глубинных к периферическим отделам мозга, однако имеются исключения.
Отдельные, ключевые этапы миелинизации хорошо прослежены с помощью МРТ, что отражено в целом ряде работ [6, 7, 10], где авторами были представлены данные, позволяющие установить МРТ-картину миелинизации различных структур белого вещества головного мозга в норме в разные сроки младенчества и при ряде патологических процессов, сопровождающихся ее нарушением или задержкой.
Кроме оценки хода миелинизации при МРТ доступно также изучение развития и формирования извилин мозга. Миелинизация и формирование извилин с точки зрения МРТ-диагностики в период новорожденности являются основными для определения наличия нарушений развития, многих наследственно обусловленных лейкоэнцефалопатий и других лейкоэнцефалопатий, связанных с воздействием иных факторов (например, гипоксия/ишемия, инфекции и др.).
Понимание концепции селективной уязвимости (избирательного повреждения) отдельных структур мозга важно в связи с тем, что она дает представление о патогенезе и интерпретации МРТ-данных ряда лейкоэнцефалопатий. Анализ большой группы наследственных и приобретенных заболеваний ЦНС позволил установить, что при многих из них те или иные структуры мозга поражаются избирательно, при визуальной и морфологической сохранности (или относительной сохранности) других структур. Поскольку чувствительность МРТ к заболеваниям белого вещества высока, концепция селективной уязвимости, применяемая к анализу патогенеза лейкоэнцефалопатий, существенно повышает специфичность МРТ-диагностики. В развитие теории селективной уязвимости внесли вклад такие ученые, как W. Spielmeyer, C. Vogt, W. Scholz, M. Johnson, A. Barkovich. На современном уровне наиболее полное развитие эта концепция получила в работах J. Valk и M. Van der Knaap [13-15, 20].
M. Van der Knaap [20] рассматривает следующие патофизиологические механизмы, которые могут объяснять избирательное повреждение тех или иных структур мозга на МРТ:
1. Уровень активности структуры в момент повреждения. Отдельные структуры мозга с высоким потреблением кислорода и химического метаболизма чрезвычайно чувствительны к гипоксии/ишемии, метаболическим нарушениям и токсическим воздействиям и будут повреждены изолированно или повреждены первыми. У взрослых серое вещество мозга активнее белого и поражается в первую очередь и более выраженно. У младенцев наибольшей активностью обладают активно миелинизирующиеся зоны и они более подвержены повреждению.
2. Специфическая химическая аффинность. Установлено, что определенные отделы мозга подвержены повреждению специфическими токсическими веществами эндо- и экзогенного происхождения.
В качестве примеров можно рассмотреть вакуолярную миелопатию новорожденных в родильном доме при употреблении для обработки кожи гексахлорфенола, болезнь кленового сиропа (генетический дефицит активности комплекса дегидрогеназ разветвленных альфа-кетокислот), отравления тяжелыми металлами, болезнь Вильсона-Коновалова и др.
3. Депонирование/дефицит определенных субстратов в мозге. Различия в избирательном повреждении могут быть связаны с различиями остаточной ферментативной активности в клетках при наследственных заболеваниях, влиянием отложения аномальных продуктов метаболизма в определенных структурах мозга, чувствительностью к отсутствию каких-либо веществ, синтез которых в мозге нарушен и т.д.
4. Распределение нейротрансмиттерных систем. Селективная уязвимость структур может быть обусловлена нейромедиаторной трансмиссией, различной в разных отделах мозга (ГАМКергическая, дофаминергическая трансмиссия, глутаматная эксайтотоксичность).
5. Плотность синапсов возбуждающих аминокислот (АМК). При многих наследственных заболеваниях происходит накопление в мозге возбуждающих АМК- и МРТ-картина повреждения в таких случаях определяется индивидуальными, генетически детерминированными различиями в зонах наибольшего скопления рецепторов к возбуждающим АМК.
6. Плотность митохондрий и процент мутантной мтДНК. Обусловливает особенности избирательного повреждения структур мозга при митохондриальных энцефаломиопатиях (метаболические инсульты).
7. Индивидуальные особенности реакций антиген/антитело. Имеют значение преимущественно при паранеопластических и параинфекционных (аутоиммунных) процессах и заболеваниях ЦНС, таких как лимбический энцефалит, острый рассеянный энцефаломиелит (ОРЭМ), РС и др.
8. Специфичность инфекционного возбудителя и входных ворот. Вирусные, бактериальные и грибковые возбудители могут иметь специфичность в отношении поражения определенных отделов мозга. Классическим примером избирательного вирусного поражения белого вещества является прогрессирующая мультифокальная лейкоэнцефалопатия, при которой JC-вирус избирательно поражает миелинобразующие олигодендроциты.
9. Водно-электролитный баланс и осмолярность. Гипо- и гиперосмолярные состояния могут приводить к селективному поражению соответственно различных отделов белого вещества, преимущественно за счет поражения немиелинизированного белого вещества. Возможно, для развития этих нарушений важны дополнительные факторы (например, индивидуальная активность ферментных систем и витаминная недостаточность). В качестве примеров можно привести интоксикацию натрием при гипернатриемии и центральный понтинный и экстрапонтинный миелинолиз.
10. Характер воздействия повреждающего фактора (тяжесть, длительность, повторяемость). Этот фактор четко прослеживается на примере гипоксических поражений мозга. Установлено, что при перинатальной асфиксии при хронической или повторной частичной гипоксии/ишемии паттерн поражения на МРТ кардинально отличается от признаков острого глубокого поражения того же генеза. В первом случае развивается перивентрикулярная лейкомаляция, а во-втором — возникают очаги повреждения в базальных ганглиях, таламусе, перироландической коре.
11. Синаптические связи между анатомическими областями в пределах воздействия повреждающего фактора. Примером могут служить транссинаптическая дегенерация в пределах треугольника Гийена-Молларе, дегенерация черной субстанции в ответ на повреждение бледного шара, зеркальные очаги повреждения в лимбической системе при первичном поражении контралатеральной стороны.
12. Период воздействия повреждающего фактора в онтогенезе. На МРТ можно выявить различные поражения при одном и том же состоянии или заболевании в зависимости от периода жизни пациента, при котором начинается воздействие повреждающего фактора (в том числе при начале экспрессии патологического гена либо проявления/снижения патологической активности фермента). Примером могут служить МРТ-проявления GM-ганглиозидозов. Хорошо известно, что эти заболевания первично поражают нейроны и аксоны, и поздние (взрослые) формы этих заболеваний приводят только к дегенерации структур серого вещества. Однако если заболевание началось до завершения миелинизации мозга (дебют в младенческом возрасте), то белое вещество также поражается.
К сожалению, современная наука пока еще располагает очень скудными данными о каскаде патогенетических изменений, происходящих в мозге на молекулярном и биохимическом уровнях при различных видах повреждений и заболеваний, в том числе наследственно обусловленных. Это допускает наличие многочисленных «белых пятен» в вышеизложенной концепции избирательности поражения.
Например, казалось бы, симметричность поражения даже при селективной уязвимости структур мозга должна быть правилом при наследственных нарушениях метаболизма, поскольку генетические факторы и метаболиты обмена одинаково представлены в правых и левых отделах мозга. Однако при некоторых заболеваниях, напротив, асимметрия поражения является правилом. В качестве примера можно привести заболевания из группы нарушений цикла мочевины и такое митохондриальное заболевание, как MELAS. Для перечисленных заболеваний характерно развитие асимметричных очагов повреждения, не соответствующих сосудистым бассейнам и распределению аномальных митохондрий в мозге. Другим примером может быть такая модель поражения, как X-сцепленная адренолейкодистрофия (X-ALD). При наиболее частой церебральной форме этого заболевания поражается глубокое белое вещество теменно-затылочных областей и валик мозолистого тела (дорсальный тип поражения) при неизвестной причине первичного вовлечения в патологический процесс именно этих зон. В 10% случаев топография поражения удивительна и абсолютно противоположна — поражается колено мозолистого тела и глубокое белое вещество лобных долей (этот тип поражения был назван нами вентральным), а еще в 5% случаев наблюдается асимметричное унилатеральное поражение [4]. Менее чем в 2-3% МРТ-наблюдений церебральной формы X-ALD при сохранении билатерального паттерна определяется сочетание дорсального и вентрального типов поражения — вентрально-дорсальный тип без какой-либо анатомической связи пораженных зон друг с другом. С точки зрения рассматриваемой концепции селективной уязвимости не ясно, почему при всех прочих равных условиях одни отделы мозга более уязвимы, а другие более резистентны к патологическому процессу, однако избирательность поражения при X-ALD четко прослеживается.
Как может показаться на первый взгляд, не все изложенные патогенетические механизмы повреждения, обусловливающие селективную уязвимость, могут иметь отношение к НЛ. Однако при анализе МРТ-изображений стоит учитывать все факторы, если диагноз пациента заранее не известен и МРТ используется для постановки диагноза. Наличие «белых пятен» вышеизложенной концепции показывает, что, возможно, существуют патогенетические механизмы, определяющие избирательность и особенности МРТ-поражений, о существовании которых мы пока не знаем, либо в возникновении неясных МРТ-типов поражений играет роль сочетание нескольких указанных механизмов, изменяющее типичные паттерны, изученные при действии одного (преобладающего) фактора из рассмотренных в концепции.
Следует также понимать, что селективная уязвимость и МРТ-картина при лейкоэнцефалопатиях не являются статичными явлениями, т.е. начальные изменения при разных заболеваниях этой группы разительно отличаются от изменений, происходящих с течением болезни. В многочисленных работах показано, что специфичность МРТ-диагностики лейкоэнцефалопатий, в том числе наследственных, выше в начале заболевания (при наличии МРТ-проявлений), чем на поздних стадиях, когда различные патогенетические механизмы могут в конечном итоге приводить к схожим МРТ-проявлениям ввиду развития многочисленных вторичных неспецифичных изменений (глиоз, атрофия и др.), нивелирующих селективность первичного поражения.
Достижения МРТ-исследований последних нескольких десятилетий, в том числе в сфере диагностики и изучения НЛ, сложно переоценить. С появлением МРТ были описаны либо уточнены проявления более 100 известных лейкоэнцефалопатий, в том числе в сопоставлении данных МРТ, морфологических исследований, полученных при аутопсии и биопсии, данных иммуногистохимических исследований и электронной микроскопии. Как уже было сказано, это стало возможным при накоплении многочисленных МРТ-данных возрастной нормы, в том числе подробном изучении этапов развития мозга и белого вещества с помощью МРТ, а также пополнении банка данных МРТ-изображений разных групп наследственных заболеваний, протекающих с лейкоэнцефалопатией: лизосомных, пероксисомных заболеваний, митохондриальных энцефаломиопатий, органических аминоацидопатий и других болезней [2, 7, 20]. Были также получены МРТ-данные визуализации известных, но до сих пор не классифицированных болезней белого вещества [18].
Кроме того, оказалось, что среди известных лейкоэнцефалопатий встречаются формы, отличные от известных по данным МРТ и не укладывающиеся в клинические описания знакомых форм при подробном анализе клинических и лабораторных данных. Таким образом, впервые с помощью МРТ были открыты такие лейкоэнцефалопатии, как мегалэнцефалическая лейкоэнцефалопатия с корковыми кистами (болезнь Ван дер Кнаап) [16], лейкоэнцефалопатия с исчезающим белым веществом (CACH-синдром) [18], лейкоэнцефалопатия с кистами и кальцинатами [9], лейкоэнцефалопатия с поражением ствола мозга, спинного мозга и повышенным лактатом при МР-спектроскопии [1, 11, 12], и целый ряд других заболеваний, для большинства которых, благодаря имеющимся сегодня лабораторным технологиям, спустя определенное время были открыты лежащие в их основе генетические дефекты.
Учитывая низкую специфичность диагностических клинических данных в группе НЛ, основными задачами современной МР-томографии являются непосредственная диагностика нозологической формы лейкоэнцефалопатии либо сужение дифференциально-диагностического ряда для последующей лабораторной диагностики и мониторирование течения заболевания в динамике. Возможности реального решения указанных задач в конкретном случае зависят от целого ряда факторов.
Во-первых, чрезвычайно важным оказывается такой фактор, как актуальный возраст больного и его возраст на момент дебюта болезни. Влияние этого фактора становится очевидным, когда, например, речь идет о заболевании, связанном преимущественно с задержкой миелинизации у ребенка первых месяцев жизни. В этом случае бывает сложно не только поставить диагноз, но и на фоне возрастной гипомиелинизации установить сам факт ее задержки, т.е. для постановки диагноза в этом случае, как правило, требуется динамический МРТ-мониторинг. Схожие сложности могут возникнуть при дебюте НЛ в пожилом возрасте, когда пациент имеет МРТ-проявления ангиогенной (сосудистой) лейкоэнцефалопатии.
Во-вторых, решение диагностической задачи у пациентов с НЛ существенно зависит от полноты проведенного МРТ-исследования. Для постановки сложного диагноза, как правило, необходимо проведение подробного и длительного МРТ-исследования, включающего не только рутинное МРТ, но и МРТ с контрастированием, а также использование времязатратных МРТ-методик ультраструктурной оценки белого вещества мозга, например таких как МР-спектроскопия. К сожалению, далеко не все медицинские центры располагают необходимым оборудованием и программным обеспечением МР-томографов для выполнении подобных задач. Проведение такого подробного МРТ-исследования, в том числе в условиях медикаментозной седации, может быть существенно затруднено, а иногда и невозможно у детей первых лет жизни, а также у пациентов с выраженными неврологическими (чаще грубыми когнитивными) нарушениями.
Третьим, часто определяющим диагностический успех, условием является наличие или отсутствие у заболевания специфического МРТ-паттерна, «узнаваемого» квалифицированным нейрорентгенологом. Сложность влияния этого фактора заключается в том, что одна и та же лейкоэнцефалопатия может иметь отличные друг от друга МРТ-проявления в зависимости от возраста дебюта, формы, стадии заболевания, что может влиять на снижение специфичности МРТ-диагностики. Также существуют лейкоэнцефалопатии, нозологическую принадлежность которых установить только на основании МРТ, без анализа клинических и лабораторных данных, вообще не представляется возможным, т.е. данные МРТ для них не специфичны.
В ряде таких случаев диагностическую значимость могут иметь дополнительные методики МРТ-визуализации.
Рутинная МРТ позволяет оценивать миелинизацию белого вещества по мере его развития. По ходу миелинизации отмечается укорочение Т1 и Т2; белое вещество становится не гипо-, а гиперинтенсивным по отношению к серому на Т1-взвешенных изображениях и не гипер-, а гипоинтенсивным по отношению к серому веществу на Т2-взвешенных изображениях. Опубликованы таблицы с указанием анатомических структур мозга и сроков наступления их нормальной миелинизации по данным МРТ [20].
Представления о строении нейропиля и миелина чрезвычайно важны для трактовки выявляемых сигнальных изменений на МРТ. Известны по крайней мере две популяции молекул воды, которые вносят вклад в формирование МР-сигнала. Первая представлена водой миелиновой оболочки; она имеет относительно короткие Т1 и Т2, поскольку большинство молекул образует преходящие водородные связи с гидроксильными и кетоновыми остатками белков и поверхностных липидов. Вторая популяция молекул воды относится к внутриаксональной и интерстициальной воде (т.е. воде вне миелиновой оболочки); эта популяция содержит большее количество свободной воды (связанной с макромолекулами) и поэтому обладает более длинными Т1 и Т2. Во временно`й шкале типичного Т1-взвешенного снимка вода миелина может диффундировать сквозь мембраны аксона и миелина и взаимодействовать с молекулами воды в других структурах. Показано, что укорочение Т1 в развивающемся белом веществе возникает параллельно с повышением концентрации холестерина и гликолипидов в миелине. Галактоцереброзиды, преобладающие в гликолипидах миелина, и холестерин имеют по несколько гидроксильных и кетоновых остатков на молекулу для взаимодействия со свободными молекулами воды. При относительно длинных периодах эхо, которые используют для получения Т2-снимков у новорожденных, сигнал от протонов связанных молекул воды в значительной мере размыт, и поэтому лишь сигнал от аксонов и внеклеточной воды вносит вклад в формирование МР-сигнала. Более того, увеличение гипоинтенсивности на Т2-снимках развивающегося мозга коррелирует по времени с химическим созреванием миелиновой оболочки, особенно с уплотнением миелиновой спирали вокруг аксона (которое связано с конформационными изменениями белков миелина) и насыщением некоторых полиненасыщенных жирных кислот в мембранах миелина. Если этот Т2-сигнал связан только с внеклеточной и аксональной водой, он может отражать протонную плотность. Снижение протонной плотности, по-видимому, отражает дальнейшее химическое созревание миелина, снижение количества аксональной воды в результате синтеза микротрубочек и микрофиламентов, а также уменьшение количества внеклеточной свободной воды в результате образования миелина (миелинизированные аксоны занимают значительно больше места, чем немиелинизированные), а также прорастание глии и ее отростков в белом веществе. К другим важным факторам относят упаковку липидов в двухслойной мембране, которая поддерживает стабильность миелина. Более того, нарушение упаковки липидов с удлинением углеводородных цепей или добавление новых двойных пучков к цепям приводит к удлинению Т2-времени релаксации.
Рутинная МРТ является базовой методикой для получения серий данных Т2- и Т1-взвешенных изображений, абсолютно необходимых для анализа рентгеносемиотики поражения при НЛ. Причем для анализа данных необходимо получить топографически идентичные аксиальные Т1- и Т2-взвешенные изображения, как более информативные и менее чувствительные к разного рода артефактным влияниям на получаемые в ходе сканирования изображения. Остальные проекции являются дополнительными, например сагиттальная проекция полезна для оценки состояния мозолистого тела. Предпочтительными являются изображения с бо’льшими матрицами, малой толщиной среза и межсрезовым промежутком; указанные параметры следует изменять таким образом, чтобы не ухудшалось качество получаемых изображений. Полученные данные должны анализироваться следующим образом: сигнальные характеристики патологических очагов (областей, зон), их симметричность/асимметричность; форма, размеры, гомогенность сигнала от пораженных структур; топическое распределение с оценкой избирательности поражения проводников и структур белого вещества; наличие отека и атрофии; наличие кист, кровоизлияний/петрификатов. Пользуясь концепцией селективной уязвимости и патернами узнавания, данные одной лишь рутинной МРТ уже могут позволить в целом ряде случаев поставить правильный диагноз при НЛ. В других случаях необходимо продолжить МРТ-исследование.
Контрастное усиление (Т1-контрастирование) при визуализации НЛ используется в случаях, когда проводится дифференциальный диагноз с токсическими, аутоиммунными и инфекционными поражениями. Для большинства НЛ контрастное усиление нехарактерно, однако для некоторых, напротив, наличие контрастного усиления является характерным МР-признаком, при этом механизм его возникновения различен и не всегда до конца ясен. Важными примерами контрастируемых лейкоэнцефалопатий являются такие заболевания, как X-сцепленная адренолейкодистрофия (парадоксальный пример выраженного аутоиммунного поражения в группе НЛ); болезнь Александера; лейкоэнцефалопатия с кистами и кальцинатами, при которых феномен контрастного усиления очагов поражения, вероятно, различен, но до сих пор точно не известен. Наблюдения контрастного усиления в группе НЛ показывают, что в случае диагностически неясной НЛ, как правило, по данным рутинной МРТ невозможно прогнозировать наличие или отсутствие контрастного усиления на снимках, поэтому мы считаем, что при неясном диагнозе и проведении дифференциального диагноза с ненаследственными формами поражений белого вещества всегда имеет смысл вводить контрастное вещество при МРТ-исследовании.
Применение этих методик осуществляется на двух уровнях: ДВ-МРТ — относительно простой уровень с быстрым получением клинически важной информации, а ДТ-МРТ с последующей трактографией — более сложный уровень, позволяющий точнее оценить и вычислить степень анизотропии диффузии и провести трехмерный (3D) анализ данных.
По ходу миелинизации происходит снижение ИКД и повышение анизотропии диффузии, что показано в целом ряде работ [2, 7, 15]. Снижение ИКД зависит от нескольких факторов. Прежде всего, уменьшается размер внеклеточного пространства в связи с пролиферацией миелина и увеличением размеров созревающих нейронов и глии. Другой причиной ограничения подвижности воды является наличие множественных слоев гидрофобной миелиновой мембраны, с этим же связано повышение анизотропии диффузии воды в развивающемся мозге. Ограничение подвижности воды происходит перпендикулярно миелиновым мембранам, но не параллельно им. Однако показано, что диффузионная анизотропия возникает еще до того, как миелин можно увидеть гистохимически или средствами электронной микроскопии. Это связано с двумя факторами: во-первых, до миелинизации увеличивается количество отростков олигодендроцитов вокруг аксонов, которые уменьшают подвижность воды перпендикулярно; во-вторых, до миелинизации синтезируются интрааксональные белковые молекулы и ионные каналы, что еще больше усложняет диффузию воды сквозь аксоны [6].
Проведение ДВ-МРТ и ДТ-МРТ при НЛ позволяет определить характер изменений диффузии воды в белом веществе мозга, что в совокупности с данными рутинной МРТ предоставляет чрезвычайно важную диагностическую информацию. Локальные выраженные ограничения ИКД характерны для митохондриальных энцефаломиопатий. Также выраженное ограничение диффузии определяется при вакуолярных миелинопатиях (болезнь Канаван, синдром кленового сиропа, болезнь Ван дер Кнаап, L2-гидроксиглутаровая ацидурия, синдром Кернса-Сейра и др.), при которых в острой и подострой стадиях отмечается выраженное ограничение ИКД, даже в большей степени, чем цитотоксический отек. На ДВ-изображениях регистрируется высокий сигнал от пораженных зон, отражающий межмиелиновый отек, вакуолизацию миелина с ограничением межклеточных пространств. Особенно полезны данные ДВ-МРТ при вакуолярных миелинопатиях у новорожденных детей, когда можно оценить степень и топическое распределение миелинизации мозга, поскольку там, где еще нет миелина, нет и проявлений вакуолярной миелопатии [15, 20].
В других случаях НЛ при деструктивных изменениях белого вещества и миелина выявляются зоны с высокими значениями ИКД (X-сцепленная адренолейкодистрофия, метахроматическая лейкодистрофия и др.). Для ряда заболеваний характерны сочетания зон с высокими ИКД и зон ограничения диффузии (болезнь Канаван), либо изменения ИКД отражают стадии патологического процесса с формированием в исходе кавитаций и деструктивных изменений в белом веществе.
Применение метода трактографии, основанного на данных ДТ-МРТ при НЛ, пока представляется ограниченным, так как вследствие сложных и часто до конца не выясненных патологических процессов, связанных с изменениями миелина, существующее программное обеспечение современных МР-томографов и графических станций постобработки не имеет в настоящее время математических алгоритмов, позволяющих избежать ошибок в визуализации трактов белого вещества при их частичном повреждении или на фоне отека.
Является в ряде случаев НЛ чрезвычайно полезной дополнительной МРТ-методикой, позволяющей получить важную информацию или даже определяющей в постановке нозологического диагноза. Яркий пример последнего — болезнь Канаван, при которой определяется выраженное повышение отношения NAA/Сr за счет накопления в мозге предшественника N-ацетиласпартата — N-ацетиласпартиковой кислоты. Повышение отношения NAA/Cr не наблюдается ни при одном другом заболевании ЦНС и позволяет при болезни Канаван провести дифференциальный диагноз с очень близкими по МРТ-картине поражениями, наблюдаемыми при инфантильной форме болезни Ван дер Кнаап и некоторых других НЛ.
Перенос намагниченности (MT, magnetization transfer) увеличивается по мере развития мозга. Это предположительно происходит за счет связывания свободной воды холестерином, галактоцереброзидами и белками двухслойной мембраны развивающегося миелина.
Для характеристики тканей обычно используется понятие отношения переноса намагниченности (magnetization transfer ratio, MTR). Формула проста: MTR=[(Mo-Ms)/Mo]·100%, где Mo — интенсивность сигнала, полученного без пре-импульса, Ms или Msat — интенсивность сигнала после применения пре-импульса. Чем сильнее МТ-эффект, тем выше отношение переноса намагниченности, MTR. MTR снижен, когда мал эффект пула протонов макромолекул. Таким образом, MTR отражает степень структурной целостности ткани мозга. Другая область применения данных MTR, вызывающая значительный интерес, — создание MTR-гистограмм как для паренхимы мозга в целом, так и для выделенных областей. Полученная таким образом относительная величина пика отражает количество сохранной ткани мозга, не зависимое от размеров мозга и степени атрофии.
Недостатком 2D- и 3D-МТ является варьирование значений МТ при использовании разных сканеров, даже при одинаковых параметрах измерений. Особое значение это имеет при многоцентровых исследованиях и при повторных исследованиях, когда для обследования одного пациента используются разные сканеры.
Наиболее часто метод МТ применяется при изучении РС, обогащая наше понимание патогенеза этого заболевания. Корреляция MTR и гистопатологического исследования при РС показало, что не только миелин является фактором, влияющим на эффект МТ. Значительная корреляция выявлена между MTR и аксональной потерей [20], поэтому MTR отражает не только плотность миелина, но и аксональную плотность.
Было показано, что при Х-сцепленной адренолейкодистрофии (X-ALD) применение МТ также важно. Как только у больного мальчика выявляются первые признаки прогрессирующей церебральной демиелинизации, предпринимается пересадка гемопоэтических стволовых клеток в качестве попытки сдержать развитие заболевания. Поскольку процедура связана со значительным риском заболеваемости и смертности, а предсказать, у кого из мальчиков — носителей биохимического и генетического дефекта в дальнейшем разовьется демиелинизирующее заболевание головного мозга либо адреномиелонейропатия, невозможно, трансплантация гемопоэтических стволовых клеток в раннем возрасте в качестве превентивной меры не может быть проведена. Тщательное регулярное МРТ-мониторирование является в настоящее время наилучшим подходом для принятия решения о необходимости и сроках проведения пересадки. Рутинная МРТ тоже важна, но неоднократно было доказано, что при X-ALD протонная МРС, диффузионно-тензорный метод и метод МТ являются более чувствительными, позволяют выявить начальные проявления и количественно оценить прогресс заболевания уже тогда, когда рутинная МРТ еще вообще не выявляет патологических сигнальных изменений в мозге. При Х-ALD было установлено, что MTR тесно коррелирует со степенью потери целостности ткани [20].
Среди дополнительных ИП, используемых для МРТ-визуализации и диагностики НЛ, следует указать такие важные ИП, как IR, SWI, 3D-SPGR.
ИП IR, подавляя сигнал фракции протонов свободной воды, позволяет получить наилучший контраст между серым и белым веществом, чаще в 3D-модификации используется для оценки патологии извилин мозга, белого вещества и хода миелинизации в сопоставлении с сигнальными характеристиками в режиме Т1. Для выявления нарушений развития извилин, патологии, связанной с нарушением нейрональной миграции, присутствующей при некоторых НЛ (например, при болезни Цельвегера), также используетс
Поврежденная обёртка
Как мне кажется, для человеческого организма вполне подходит следующее правило: если есть орган, значит, к нему должна быть болезнь. В принципе, это правило можно расширить до молекулярных процессов: есть процесс — есть и болезни, связанные с нарушением этого процесса.
В случае с миелином это демиелинизирующие заболевания. Их довольно много, но подробнее я расскажу о двух — синдроме Гийена-Барре и рассеянном склерозе. При этих расстройствах повреждение миелина приводит к нарушению адекватного проведения сигнала по нервам, что и обуславливает симптомы болезни.
Синдром Гийена-Барре (СГБ) — это заболевание периферической нервной системы, при котором происходит разрушение миелиновой оболочки, формируемой шванновскими клетками. СГБ является классическим аутоиммунным заболеванием. Как правило, ему предшествует инфекция (часто — вызванная микробом Campylobacter jejuni).
Присутствие различных возбудителей в организме человека запускает аутоиммунное повреждение миелина нервных волокон T- и B-лимфоцитами. Клинически это проявляется мышечной слабостью, нарушением чувствительности по типу «носки — перчатки» (полиневритический тип) (рис. 5).
В дальнейшем мышечная слабость может нарастать вплоть до полного паралича конечностей и поражения туловищной мускулатуры. Поражения чувствительной нервной системы также могут быть разнообразны: от снижения способности различать собственные движения (нарушение глубокой чувствительности) до выраженного болевого синдрома.
При тяжелых формах СГБ главную опасность представляет потеря способности к самостоятельному дыханию, требующая подключения к аппарату искусственной вентиляции легких (ИВЛ). Для лечения СГБ в настоящее время используют плазмаферез (очистку плазмы от вредных антител) и внутривенные вливания препаратов человеческого иммуноглобулина для нормализации иммунного ответа. В большинстве случаев лечение приводит к стойкому выздоровлению.
Рассеянный склероз (РС) заметно отличается от СГБ. Во-первых, это демиелинизирующее заболевание приводит к поражению центральной нервной системы, то есть затрагивает миелин, синтезируемый олигодендроцитами. Во-вторых, с причинами РС до сих пор много неясного: слишком большое разнообразие генетических и средовых факторов задействовано в патогенезе заболевания.
Принципиальный момент в запуске РС — нарушение непроницаемости гематоэнцефалического барьера (ГЭБ) для иммунных клеток. В норме ткань мозга отгорожена от всего остального организма этим надежным фильтром, который не пропускает к ней множество веществ и клеток, в том числе иммунных.
ГЭБ появляется уже в эмбриональном периоде развития, изолируя ткань мозга от формирующейся иммунной системы. В это время иммунная система человека «знакомится» со всеми существующими тканями, чтобы в дальнейшем, при взрослой жизни, не нападать на них.
Мозг и ряд других органов остаются «не представленными» иммунной системе. При нарушении целостности ГЭБ иммунные клетки получают возможность для атаки незнакомых ей тканей мозга. В-третьих, РС отличается более тяжелыми симптомами, которые требуют других терапевтических подходов.
Симптоматика зависит от того, где локализуются повреждения нервной системы (рис. 6 и 7). Это может быть шаткость походки, нарушения чувствительности, различные когнитивные симптомы. Для лечения РС используются высокие дозы глюкокортикоидов и цитостатики, а также препараты интерферона и специфические антитела (натализумаб).
По-видимому, в дальнейшем будут развиваться новые методы лечения РС, основанные непосредственно на восстановлении миелиновой оболочки в поврежденных участках мозга. Ученые указывают на возможность трансплантации клеток — предшественниц олигодендроцитов или усиления их роста за счет введения инсулиноподобного фактора роста или тиреоидных гормонов [11]. Однако это еще впереди, а пока неврологам недоступны более «молекулярные» методы лечения.
- Wu L.M., Williams A., Delaney A., Sherman D.L., Brophy P.J. (2021). Increasing internodal distance in myelinated nerves accelerates nerve conduction to a flat maximum. Curr. Biol.22, 1957–1961;
- Harauz G. and Boggs J.M. (2021). Myelin management by the 18.5-kDa and 21.5-kDa classic myelin basic protein isoforms. J. Neurochem.125, 334–361;
- Kassmann C.M. (2021). Myelin peroxisomes — essential organelles for the maintenance of white matter in the nervous system. Biochemie. 98, 111–118;
- Venkatesh H.S., Johung T.B., Caretti V., Noll A., Tang Y., Nagaraja S. et al. (2021). Neuronal activity promotes glioma growth through neuroligin-3 secretion. Cell. 161, 803–816;
- Tomassy G.S. and Fossati V. (2021). How big is the myelinating orchestra? Cellular diversity within the oligodendrocyte lineage: facts and hypotheses. Front. Cell Neurosci.8, 201;
- Michalski J.-P. and Kothary R. (2021). Oligodendrocytes in a nutshell. Front. Cell Neurosci.9, 340;
- Salzer J.L. (2021). Axonal regulation of Schwann cell ensheathment and myelination. J. Peripher. Nerv. Syst.17, 14–19;
- Eluvathingal T.J., Chugani H.T., Behen M.E., Juhász C., Muzik O., Maqbool M. et al. (2006). Abnormal brain connectivity in children after early severe socioemotional deprivation: a diffusion tensor imaging study. Pediatrics. 117, 2093–2100;
- Prado E.L. and Dewey K.G. (2021). Nutrition and brain development in early life. Nutr. Rev.72, 267–284;
- Hulshoff Pol H.E., Hoek H.W., Susser E., Brown A.S., Dingemans A., Schnack H.G. et al. (2000). Prenatal exposure to famine and brain morphology in schizophrenia. Am. J. Psychiatry.157, 1170–1172;
- Bhatt A., Fan L.W., Pang Y. (2021). Strategies for myelin regeneration: lessons learned from development. Neural. Regen. Res.9, 1347–1350.